再生医療の導入や継続的な提供において、医療機関の担当者を最も悩ませるのが「再生医療等の安全性の確保等に関する法律(再生医療等安全性確保法)」に基づく複雑な手続きではないでしょうか。
新規の提供計画を提出する際や、法改正に伴う変更届が必要な場面で、正確な情報を把握し、ミスなく業務を進めることは容易ではありません。
不備による差し戻しは、医療提供の開始遅延だけでなく、医院の信頼性にも関わる重要な問題です。
本記事では、再生医療に関わる法規制と届出ガイドとして、法規制の全体像からリスク分類ごとの対応、具体的な届出フロー、そして審査をスムーズに通過させるためのポイントまでを網羅的に解説いたします。
実務担当者の方が手元に置いて確認できるマニュアルとして、ぜひご活用ください。
再生医療等の安全性の確保等に関する法律(再生医療等安全性確保法)の概要と届出の義務
再生医療を提供するすべての医療機関は、患者様の安全を守るために制定された「再生医療等の安全性の確保等に関する法律」を遵守する義務があります。
この法律は、急速に進歩する再生医療技術を速やかに、かつ安全に国民へ提供するための枠組みを定めたものです。
ここではまず、法律の目的や基本的な義務、違反時のリスクといった基礎知識について整理していきましょう。
再生医療等安全性確保法の目的と法規制の全体像
平成26年に施行された「再生医療等の安全性の確保等に関する法律(以下、再生医療等安全性確保法)」は、再生医療等の安全性を確保し、国民の生命および健康を守ることを最大の目的としています。
従来、薬機法(旧薬事法)や医師法の下で行われていた再生医療について、リスクに応じた明確な基準を設けることで、医療機関が適切な体制で実施できるよう整備されました。
この法律の全体像としては、主に以下の3つの柱で構成されています。
- 再生医療等の提供基準: 実施する医療機関が満たすべき施設要件や人員要件
- 認定再生医療等委員会による審査: 第三者機関による科学的妥当性と倫理性のチェック
- 細胞培養加工施設の基準: 細胞加工物の製造管理および品質管理の基準(GCTP相当)
これらを遵守することで、質の高い医療の提供が可能となります。
医療機関に課される再生医療提供計画の届出義務
医療機関が再生医療等を行う場合、あらかじめ「再生医療等提供計画」を作成し、厚生労働大臣(地方厚生局)へ提出することが義務付けられています。
これは、大学病院などの特定機能病院だけでなく、街のクリニックや歯科医院であっても例外ではありません。
重要なのは、計画を提出する前に、厚生労働省の認定を受けた「認定再生医療等委員会」にて審査を受け、適格であるとの意見書を取得する必要がある点です。
つまり、自院の判断だけで勝手に治療を開始することはできず、必ず第三者の厳しいチェックを経なければならない仕組みとなっています。
このプロセスを経ずに医療を提供することは、法律違反となるため十分な注意が必要です。
自由診療と臨床研究における手続きの違い
再生医療等安全性確保法は、患者様が全額自己負担する「自由診療」であっても、研究目的で行われる「臨床研究」であっても、等しく適用されます。
しかし、その目的の違いから、手続きや適用される基準に一部差異が存在します。
自由診療と臨床研究の主な違い
- 自由診療: 治療を主目的とし、治療費は患者負担。提供計画の提出先は地方厚生局となります。
- 臨床研究: 有効性や安全性の検証を主目的とする研究。臨床研究法も関与する場合があり、より厳格なモニタリングや監査が求められることがあります。
どちらのケースであっても、法規制に基づいた適切な届出が必須であることに変わりはありません。それぞれの目的に合致した計画書を作成しましょう。
無届で実施した場合の罰則規定
もし、必要な提供計画の届出を行わずに再生医療等を実施した場合、あるいは虚偽の届出を行った場合には、厳しい罰則が科されます。
具体的には、1年以下の懲役もしくは100万円以下の罰金、またはその両方が科される可能性があります。
さらに、厚生労働大臣による「再生医療等の提供の一時停止命令」や「中止命令」が出されることもあり、医療機関としての存続に関わる重大な事態を招きかねません。
また、行政処分だけでなく、違法な医療行為として社会的な信用を失墜させるリスクも極めて高いといえます。
コンプライアンスを遵守し、正規の手続きを経て医療を提供することは、患者様だけでなく、医療機関自身を守るためにも不可欠です。
【リスク分類別】再生医療等の区分と対応する認定再生医療等委員会
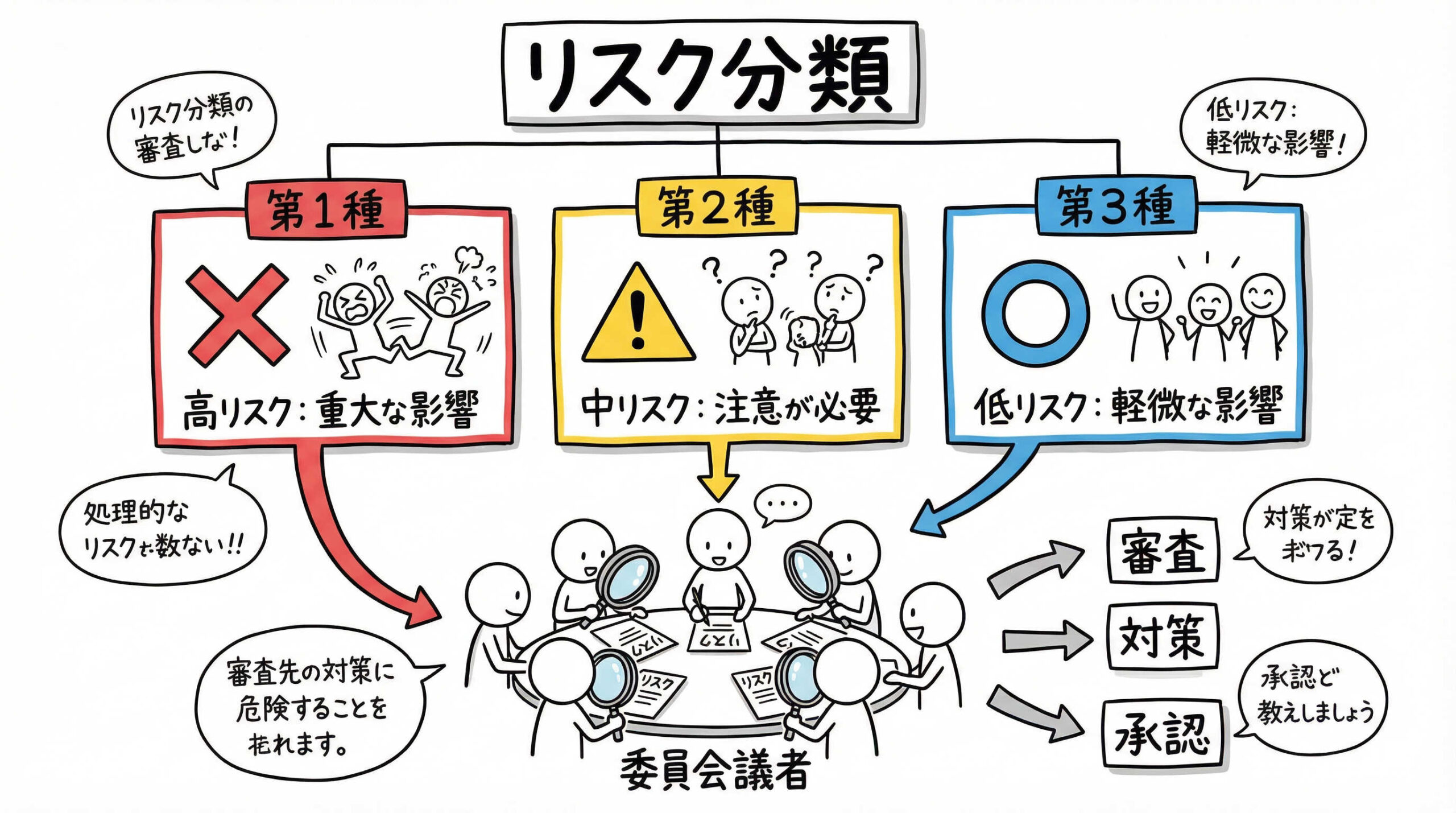
再生医療等安全性確保法では、提供する医療技術が人体に及ぼすリスクの程度に応じて、第一種から第三種までの3つのカテゴリーに分類しています。
この区分によって、審査を担当する委員会や手続きの厳格さが異なります。
ご自身が提供しようとしている治療がどの区分に該当するかを正確に把握することは、届出業務の第一歩です。
第一種再生医療等(高リスク)の定義と該当技術
第一種再生医療等は、人の生命や健康に重大な影響を与える恐れがある、最もリスクが高い技術として分類されています。
これまでヒトで実施された実績が極めて少ない、あるいは全くない技術がこれに該当します。
主な該当技術の例
- ES細胞(胚性幹細胞)を使用するもの
- iPS細胞(人工多能性幹細胞)を使用するもの
- 他人の細胞(同種細胞)を使用するもの
- 動物の細胞を使用するもの
第一種は、その新規性とリスクの高さから、審査基準が非常に厳格です。
提供計画の審査は、より専門的な知見を持つ「特定認定再生医療等委員会」で行う必要があり、さらに厚生労働大臣への提出期間も90日(審査期間含む)と長く設定されています。
第二種再生医療等(中リスク)の定義と該当技術
第二種再生医療等は、中程度のリスクがあるとされる技術です。
人の生命や健康に影響を与える可能性はあるものの、第一種ほど未知の領域ではないものが分類されます。
現在、多くの美容クリニックや整形外科で行われている幹細胞治療の多くが、この第二種に含まれます。
主な該当技術の例
- 自己の体性幹細胞(脂肪由来幹細胞など)を使用するもの
- 培養した細胞を使用するもの(構造や機能が変化する場合)
第二種の場合も、第一種と同様に「特定認定再生医療等委員会」での審査が必須となります。
通常の認定再生医療等委員会では審査できないため、委員会選びの際には注意が必要です。
第三種再生医療等(低リスク)の定義と該当技術
第三種再生医療等は、細胞の加工を行っても元の細胞の性質が大きく変わらないなど、リスクが比較的低いとされる技術です。
整形外科や歯科、美容皮膚科などで広く普及している治療法が多く該当します。
主な該当技術の例
- PRP(多血小板血漿)療法
- 加工を施さない細胞の使用
- 培養を行わず、遠心分離などで調製した細胞の使用
第三種の場合、審査は「認定再生医療等委員会」で行うことができます。
特定認定再生医療等委員会よりも設置数が多く、比較的審査のハードルは低い傾向にありますが、書類の正確性や安全管理体制の整備が必要であることに変わりはありません。
特定認定再生医療等委員会と認定再生医療等委員会の審査権限の違い
ここまで触れてきたように、リスク区分によって審査を依頼できる委員会が異なります。
この違いを理解しておかないと、契約段階で手戻りが発生してしまいます。
委員会の種類と権限
- 特定認定再生医療等委員会:
- 高度な専門性と中立性が求められる委員会。
- 第一種・第二種・第三種すべての審査が可能。
- 構成員に細胞生物学等の専門家が含まれるなど要件が厳しい。
- 認定再生医療等委員会:
- 一定の基準を満たした委員会。
- 第三種のみ審査が可能。
- 比較的身近な医療機関や団体が設置していることが多い。
第二種以上の技術を提供する場合、必ず「特定」の認定を受けた委員会を探す必要があります。
新規で再生医療提供計画を提出する際の実務フロー
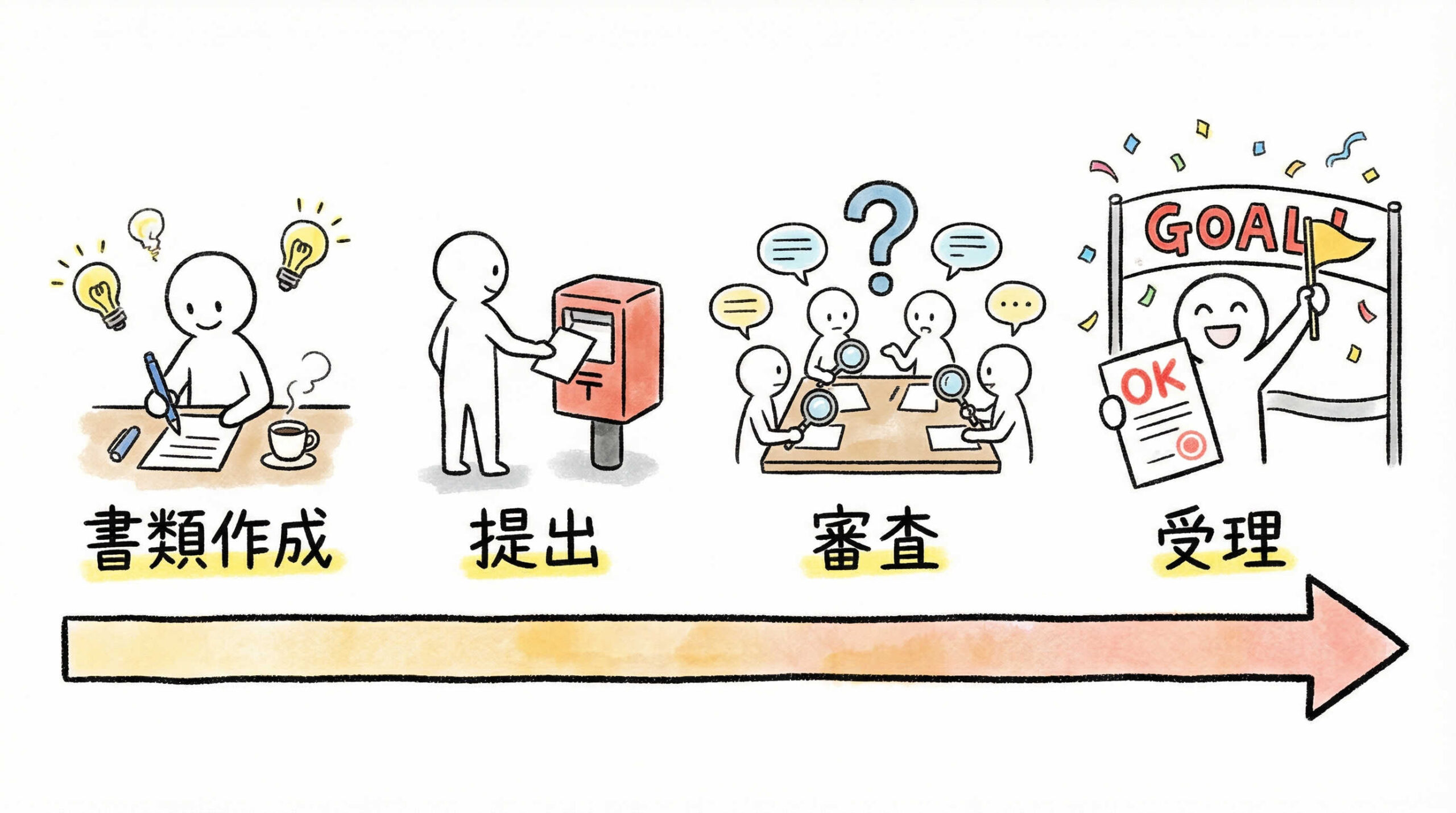
法規制と区分の理解が深まったところで、実際に新規で再生医療提供計画を提出する際の流れを見ていきましょう。
書類作成から提出、受理に至るまでには複数のステップがあり、スムーズに進んでも数ヶ月を要することが一般的です。
全体のフローを把握し、余裕を持ったスケジュールを組むことが大切です。
ステップ1:提供する再生医療等の区分の特定
最初に行うべきは、提供予定の治療法が第一種から第三種のどの区分に該当するかを明確にすることです。
これは、使用する細胞の種類(自己か他家か)、加工の方法(培養の有無、薬剤処理の有無)、投与方法によって決まります。
判断に迷う場合は、厚生労働省のガイドラインを参照するか、専門のコンサルタントや行政書士に相談することをお勧めします。
区分を誤って準備を進めてしまうと、後の委員会選定や書類作成がすべて無駄になってしまう恐れがあるため、慎重に特定しましょう。
ステップ2:審査を依頼する認定再生医療等委員会の選定と契約
区分が決まったら、審査を依頼する委員会を選定します。
第三種であれば選択肢は多いですが、第一種・第二種の場合は「特定認定再生医療等委員会」に限られるため、早めのリサーチが必要です。
委員会を選定する際は、以下の点を確認すると良いでしょう。
- 審査料金(委員会によって大きく異なります)
- 審査の開催頻度(月に1回か、数ヶ月に1回か)
- 事務局の対応スピードやサポート体制
条件に合う委員会が見つかったら、審査依頼の契約を締結します。この時点で審査料の支払いが発生するケースが一般的です。
ステップ3:委員会への審査申請とヒアリング対応
契約後、必要書類一式を委員会へ提出し、審査を申請します。
委員会では、提出された書類に基づき、技術的な妥当性、安全性、倫理的な配慮、実施体制などが厳しくチェックされます。
審査会当日は、実施責任者(医師)等の出席を求められ、委員からの質疑応答(ヒアリング)が行われることがほとんどです。
「なぜこの治療が必要なのか」「安全対策はどうなっているか」といった質問に対し、的確に回答できるよう準備を整えておきましょう。
ここで不明瞭な回答をすると、継続審査となり時間がかかる原因になります。
ステップ4:委員会からの「意見書」受領
審査の結果、提供計画が「適」と認められれば、委員会から「意見書」が発行されます。
この意見書は、国への届出を行う際に必須となる最重要書類の一つです。
場合によっては「条件付き適」となり、指摘事項への修正対応が求められることもあります。
その際は速やかに修正を行い、委員会の確認を経て意見書を受領しましょう。
意見書には有効期限がある場合もあるため、受領後は速やかに次のステップへ進むことが肝要です。
ステップ5:地方厚生局への再生医療等提供計画の提出
委員会からの意見書と、修正済みの最終版の提供計画書、その他添付書類一式を揃えて、管轄の地方厚生局へ提出します。
現在は、オンラインシステム(e-Gov等と連携した再生医療等各種申請書作成支援サイト)を利用して手続きを行うのが一般的です。
第一種の場合は厚生労働大臣への提出となり、提出から実施可能になるまで一定の制限期間(通常90日)が設けられています。
第二種・第三種の場合は地方厚生局長への提出となり、受理されれば速やかに実施が可能となりますが、手続き上のタイムラグを考慮しておきましょう。
ステップ6:受付完了と受理通知の受領
地方厚生局での形式審査を経て、問題がなければ計画が受理されます。
受理されると、再生医療等提供計画に「計画番号」が付与され、受理通知が届きます。
この番号が発行されて初めて、患者様への再生医療の提供が可能となります。
受理通知は大切に保管し、医療機関内の掲示板やウェブサイト等で、再生医療を提供している旨を患者様へ公表することが望ましいでしょう。
ここまでの工程を完了して、ようやくスタートラインに立ったことになります。
提供計画の届出に必要な主な添付書類と作成のポイント

再生医療の届出において最も労力を要するのが、膨大な添付書類の作成です。
これらの書類は単なる形式的なものではなく、安全性を証明するための根拠資料となります。
ここでは、特に重要となる主要な書類とその作成ポイントについて解説します。
再生医療等提供計画書(様式第一)
すべての基本となるのが「再生医療等提供計画書(様式第一)」です。
ここには、実施する医療機関の名称、管理者、実施責任者、使用する細胞の種類、対象疾患、提供方法などを詳細に記載します。
作成のポイント
- 整合性: 他の添付書類(説明文書や手順書)の内容と矛盾がないか徹底的に確認します。
- 具体性: 「適宜実施する」といった曖昧な表現は避け、具体的な数値や手順を記載します。
システム入力が主となりますが、記載ミスはそのまま受理の遅れに繋がるため、入力後のダブルチェックは欠かせません。
再生医療等の提供に係る説明文書及び同意文書
患者様への説明と同意(インフォームド・コンセント)に使用する文書です。
法規制上、必ず記載しなければならない項目が細かく定められています。
必須項目の例
- 再生医療等の内容と期待される効果
- 予期されるリスク・副作用
- 他の治療法との比較
- 健康被害が発生した場合の補償内容
- 同意の撤回が可能であること
専門用語を並べるのではなく、一般の患者様が理解できる平易な言葉で記述することが求められます。
委員会審査でも特に厳しくチェックされる項目ですので、丁寧な作り込みが必要です。
実施体制確認書と人員配置の要件
安全に医療を提供できる体制があるかを示す書類です。
実施責任者や実施医師、細胞培養加工担当者などの氏名、資格、略歴を記載します。
人員要件の注意点
- 実施責任者: 再生医療に関する十分な知識と経験を有していることが求められます。学会認定医などの資格や、過去の研究業績が必要となる場合があります。
- 配置: 常に連絡が取れる体制や、緊急時のバックアップ体制が整っていることを示す必要があります。
資格証の写しや履歴書の添付も必要になるため、早めにスタッフから回収しておきましょう。
細胞培養加工施設の届出または外部委託契約書
再生医療に使用する細胞をどこで加工するかによって、提出書類が異なります。
- 院内で加工する場合: 院内の細胞培養加工施設(CPC)について、別途届出を行い、その届出書の写しを添付します。
- 外部に委託する場合: 特定細胞加工物製造許可を持つ企業等との「委託契約書」の写しを添付します。
細胞の品質は安全性の根幹に関わるため、加工施設の管理状況や契約内容は厳密に審査されます。
特に院内加工の場合は、施設図面や製造管理手順書の整備も必要となります。
科学的根拠を示す添付資料(論文・データ等)
提供しようとする再生医療が、科学的に妥当であることを示すための資料です。
第一種・第二種の場合は特に重要視されます。
資料として有効なもの
- 査読付きの学術論文(当該治療法に関するもの)
- 自院または他院での過去の症例データ
- 基礎研究のデータ
単に「効果がある」と主張するのではなく、客観的なデータに基づいて有効性と安全性を説明する必要があります。
第三種の場合でも、医学的な根拠を示す資料の添付は必須です。
苦情処理及び健康被害補償に関する手順書
万が一、治療によって患者様に健康被害が生じた場合の対応策を定めた文書です。
- 苦情処理: 窓口の設置、対応フロー、記録の保存方法などを定めます。
- 健康被害補償: 民間の賠償責任保険への加入状況や、補償の範囲、金額の上限などを明記します。
「誠意を持って対応します」といった精神論ではなく、具体的な補償内容(治療費の負担、見舞金の支給など)をあらかじめ定めておくことが、患者保護の観点から強く求められます。
保険証券の写しの添付も必要です。
運用開始後に発生する定期報告と変更届の手続き
再生医療等提供計画は、一度受理されれば終わりではありません。
運用開始後も、法律に基づいた定期的な報告や、状況に応じた変更手続きが継続的に発生します。
これらの管理を怠ると、最悪の場合、計画の取り消し処分を受ける可能性もあります。
運用フェーズで事務担当者が押さえておくべきタスクを確認しましょう。
1年ごとの定期報告書の作成と提出期限
再生医療等を提供している医療機関は、1年に1回、実施状況を地方厚生局へ報告する義務があります。
これを「定期報告」と呼びます。
報告内容
- 実施件数
- 有害事象の有無
- 実施に伴う情報の評価結果
提出期限
原則として、提供計画が受理された日から起算して1年ごとに報告が必要です。
期限を過ぎてしまうと指導の対象となるため、カレンダーやリマインダーで管理し、期限の1〜2ヶ月前から準備を始めることをお勧めします。
委員会の意見を聞く必要はなく、直接厚生局へ報告します(ただし委員会への報告も別途必要な場合があります)。
疾病等報告書の提出要件(有害事象発生時)
治療によって患者様に予期せぬ健康被害(有害事象)が発生した場合や、感染症の発生が疑われる場合は、「疾病等報告書」を速やかに提出しなければなりません。
報告のタイミング
- 死亡や重篤な事例: 発生を知った時点から直ちに報告が必要です。
- その他の事例: 発生を知った日から15日以内(または30日以内)に報告します。
この報告は、認定再生医療等委員会と地方厚生局の両方に行う必要があります。
院内での情報共有フローを確立し、緊急時に即座に対応できる体制を整えておくことが重要です。
軽微な変更届で済むケース
提供計画の内容に変更が生じた場合、その内容によって手続きが異なります。
「軽微な変更」とされる場合は、委員会での審査を経ずに、地方厚生局への届出のみで済みます。
軽微な変更の例
- 実施医師の追加や変更(実施責任者の変更を除く)
- 事務連絡担当者の変更
- 単なる誤字脱字の修正
- 添付資料の更新(内容に変更がない場合)
手続きは簡素ですが、変更から30日以内(場合によっては事前)に届出を行う必要があります。
何が「軽微」に当たるかは法令で定められているため、自己判断せず確認しましょう。
重大な変更により再審査が必要となるケース
治療の安全性や科学的妥当性に影響を与えるような変更は、「重大な変更」とみなされます。
この場合、新規申請と同様に、改めて認定再生医療等委員会での審査を受け、意見書を取得した上で変更届を提出する必要があります。
重大な変更の例
- 対象疾患の変更や追加
- 細胞の加工方法の変更
- 実施責任者の変更
- 医薬品等の用量の変更
審査には費用と時間がかかるため、変更を予定している場合は、早めに委員会へ相談し、スケジュールを調整することが大切です。
無断で変更して実施すると、無届実施とみなされる危険性があります。
提供計画の廃止または一時停止の手続き
再生医療の提供を終了する場合や、一時的に中断する場合には、「中止届」または「一時停止届」を提出します。
- 廃止(中止): 今後、当該計画に基づく医療を行わない場合。提供終了後、速やかに提出します。
- 一時停止: 医師の休職などにより一時的に提供できないが、再開の予定がある場合。
廃止する場合でも、それまでの経過報告や、患者情報の保存義務(10年または50年)は残ります。
事業を畳む際も、最後まで法的な責任を全うする姿勢が求められます。
審査での差し戻しを防ぐための重要チェックポイント
認定再生医療等委員会や地方厚生局の審査において、書類の不備による「差し戻し」は、スケジュールの遅延を招く大きな要因です。
一発でスムーズに通過させるためには、審査員がどこを重点的に見ているかを知ることが近道です。
ここでは、実務担当者が提出前に必ず確認すべきチェックポイントをご紹介します。
説明文書における専門用語の平易化とリスク説明の具体性
最も指摘が多いのが、患者様向けの説明文書です。
医療従事者にとっては当たり前の言葉でも、一般の方には理解できないことが多々あります。
チェックポイント
- 専門用語(「分化」「生着」など)に注釈や簡単な言い換えがあるか。
- 「絶対に治る」といった誤解を招く表現がないか。
- リスクについて、発生頻度や具体的な症状が隠さず記載されているか。
「中学生が読んでも理解できるレベル」を目安に作成し、事務スタッフなど医療職以外の人に読んでもらって確認するのも有効な手段です。
分かりやすさは、患者様の不安を取り除く上でも重要です。
実施体制における医師・培養技術者の資格要件確認
実施体制に関しては、形式的な要件を満たしているかが厳しく見られます。
特に、医師や培養技術者の経歴と資格が、提供する技術に見合っているかが焦点となります。
チェックポイント
- 実施責任者は、当該分野での臨床経験や研究業績を有しているか。
- 添付された履歴書や業績リストは最新のものか。
- 講習会の受講修了証などの有効期限は切れていないか。
書類上の経歴と、計画書に記載された役割に不整合がないよう、細部まで照らし合わせて確認しましょう。
不足がある場合は、講習の受講などで要件を満たしてから申請する必要があります。
細胞加工物の製造管理・品質管理(GCTP)との整合性
院内で細胞培養を行う場合、GCTP(再生医療等製品の製造管理及び品質管理の基準)の考え方に準拠した管理体制が求められます。
チェックポイント
- 標準作業手順書(SOP)は整備されているか。
- 製造記録や品質管理記録の様式は整っているか。
- 試薬の管理や機器のメンテナンス記録は適切か。
手順書があっても、実態と乖離していては意味がありません。
「書かれている通りに実施できるか」「記録が残せるか」という観点で、現場のスタッフと連携して確認することが大切です。
最新の通知・事務連絡に基づく様式の確認
再生医療に関する法律や通知は、頻繁に改正や発出が行われます。
古い様式を使って書類を作成してしまうと、それだけで差し戻しの対象となります。
チェックポイント
- 厚生労働省のウェブサイトで最新の様式をダウンロードしているか。
- 最新の「疑義解釈(Q&A)」や事務連絡をチェックしているか。
特に、押印廃止やデジタル化に伴う様式の変更は見落としがちです。
常に最新情報をキャッチアップし、古いテンプレートを使い回さないように注意しましょう。
専門家のサポートを受けることで、こうした情報更新の手間を省くことも可能です。
まとめ
再生医療に関わる法規制と届出ガイドについて、法的な枠組みから具体的な手続きフロー、書類作成のポイントまで解説してきました。
再生医療等安全性確保法に基づく届出は、非常に複雑で専門的な知識を要する業務です。
しかし、これらはすべて「患者様の安全」と「医療の質」を担保するための重要なプロセスです。
適切な手続きを経て受理された提供計画は、医療機関としての信頼の証でもあります。
まずは自院が提供する技術のリスク区分を正しく理解し、適切な委員会を選定することから始めましょう。
そして、書類作成においては「整合性」と「分かりやすさ」を意識し、最新のルールに則って準備を進めてください。
不明な点は行政の窓口や専門家に相談しながら、確実な届出業務を遂行していきましょう。
再生医療に関わる法規制と届出ガイドについてよくある質問

Q1. 再生医療等提供計画の審査にはどのくらいの期間がかかりますか?
審査期間は委員会の開催頻度や混雑状況によりますが、申請から意見書受領まで概ね1〜3ヶ月程度かかることが一般的です。その後の厚生局への届出と受理まで含めると、準備開始から提供開始まで半年程度を見込んでおくと安心です。
Q2. 認定再生医療等委員会の審査料はいくらくらいですか?
委員会によって大きく異なりますが、初回の審査料として30万円〜100万円程度が相場です。これに加え、毎年の定期審査料や変更審査料などが別途かかります。複数の委員会に見積もりを依頼して比較検討することをお勧めします。
Q3. 届出をせずにPRP療法を行ってもバレないのでしょうか?
無届での実施は法律違反であり、内部告発や患者様からの通報、厚生局の立入検査などで発覚するケースが増えています。発覚した場合は罰則だけでなく、医療機関名の公表など社会的制裁を受けることになり、病院経営に致命的なダメージを与えます。必ず正規の手続きを行ってください。
Q4. 事務担当者だけで書類作成は可能ですか?
様式の入力などは事務担当者でも可能ですが、医学的な妥当性や安全性の説明、細胞培養の技術的な記述には、医師や培養技術者の協力が不可欠です。また、法的な解釈が必要な場面も多いため、行政書士などの専門家のサポートを受ける医療機関も多くあります。
Q5. 過去に作成した提供計画書を他の治療にも使い回せますか?
全く同じ治療法であれば参考にはなりますが、対象疾患や使用する細胞、加工方法が少しでも異なれば、リスク評価や科学的根拠が異なるため、そのまま使い回すことはできません。それぞれの治療法に合わせて、個別に内容を精査し作成する必要があります。