医療技術の進歩は目覚ましく、中でも再生医療は、従来の「対症療法」から「根治」へと医療のパラダイムシフトを起こしつつあります。研究開発の段階を経て、いよいよ産業化フェーズへと移行し始めた今、関連企業や医療機関においては、最新の動向を正確に把握することが求められているでしょう。
しかし、専門性が高く、かつ情報の更新サイクルが早いため、「基礎知識を改めて整理したい」「最新のビジネストレンドを押さえておきたい」とお考えの方も多いのではないでしょうか。本記事では、再生医療の基礎知識から、法規制のポイント、そしてエクソソームや遺伝子治療との融合といった最新トレンドまで、ビジネス実務に役立つ視点で体系的に解説いたします。ぜひ、貴社の事業戦略や日々の業務にお役立てください。
再生医療の定義と産業化に向けた現在の市場概況
再生医療は、失われた身体機能の回復を目指す革新的な医療分野として、世界中で注目を集めています。ここでは、再生医療の基本的な定義を再確認するとともに、研究室レベルから産業レベルへと大きく舵を切りつつある現在の市場概況について、全体像を把握していきましょう。
再生医療とは:失われた機能の修復と根本治療へのアプローチ
再生医療とは、病気や事故などで失われた組織や臓器の機能を、細胞や組織を用いて修復・再生することを目指す医療です。従来の薬物療法が症状の緩和や進行抑制を主目的としていたのに対し、再生医療は「機能の回復」や「根本的な治療」を可能にする点で画期的と言えるでしょう。
具体的には、患者自身の細胞や他者の細胞を培養・加工して体内に移植したり、細胞の持つ修復能力を引き出す手法などが含まれます。これにより、これまで治療法がなかった難治性疾患に対する新たな解決策として期待が高まっています。
研究開発段階から実用化・産業化フェーズへの移行
かつては大学や研究機関での基礎研究が主でしたが、近年では製薬企業やバイオベンチャーによる実用化・産業化が急速に進展しています。多くの再生医療等製品が承認され、実際の臨床現場で使用されるケースも増えてきました。
この移行期においては、単なる科学的な有効性の証明だけでなく、安定的な製造プロセスの確立やコストダウン、物流網の整備といった「ビジネスとしての持続可能性」が重要な鍵となります。アカデミア発のシーズをいかにして市場に適合させるか、その橋渡しが現在の大きなテーマとなっているのです。
国内外における再生医療等製品の市場規模と成長予測
再生医療の市場規模は、国内外を問わず右肩上がりの成長を続けています。経済産業省や各種調査会社のレポートによれば、世界市場は2030年、2040年に向けて数兆円、数十兆円規模へと拡大すると予測されています。
特に、がん免疫療法や遺伝子治療製品の台頭が市場を牽引しており、日本国内においても条件及び期限付承認制度などの後押しを受けて、市場拡大が加速しています。この成長市場において、どのようなポジショニングを取るかが、企業の成長戦略において極めて重要になるでしょう。
【基礎知識】実務で押さえるべき細胞源の分類と特性
再生医療ビジネスにおいて、使用する「細胞」の特性を理解することは不可欠です。どの細胞を選ぶかによって、治療効果はもちろん、製造コストや法規制のハードルも大きく異なります。ここでは、実務で頻出する主要な細胞源について整理します。
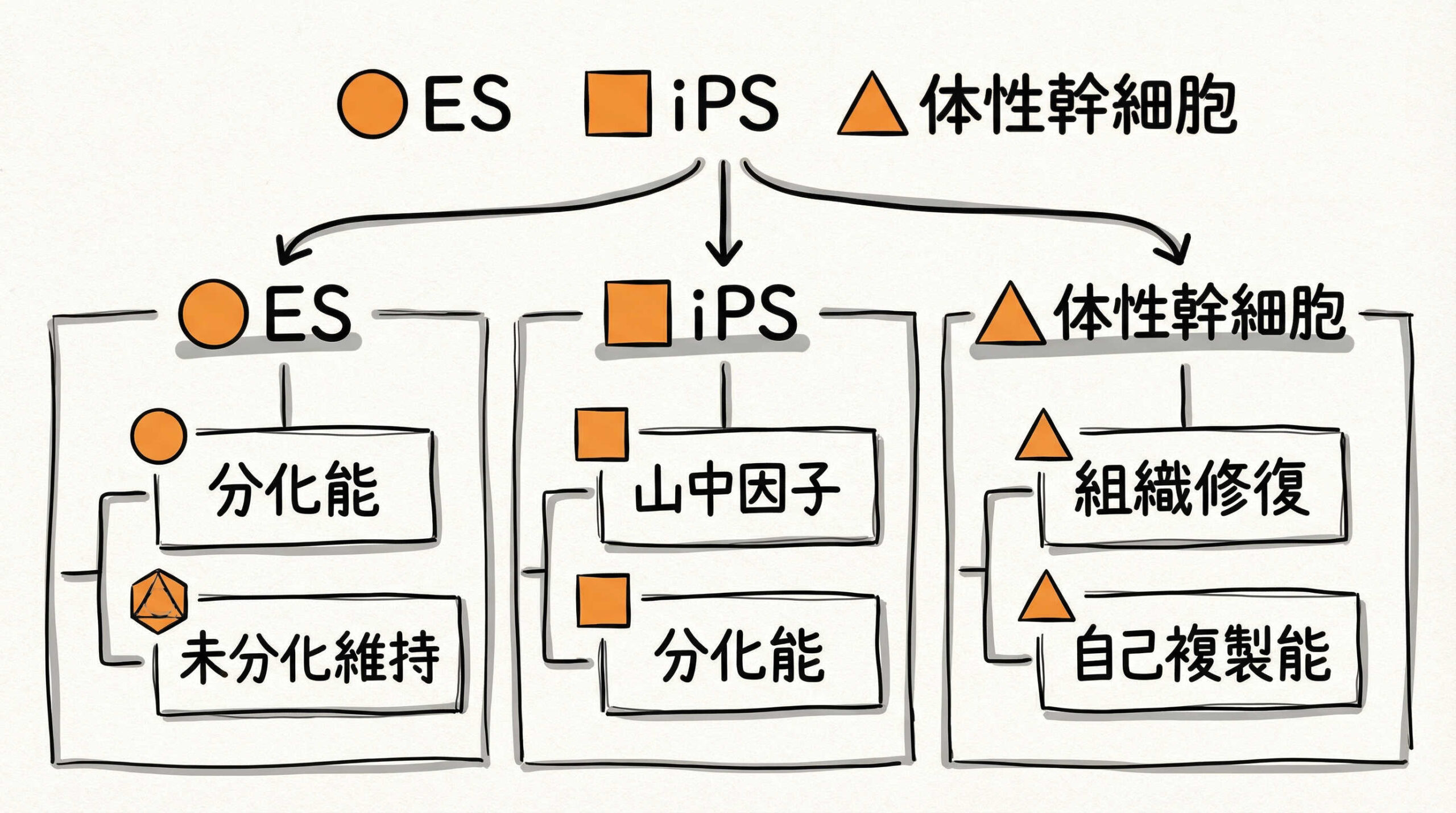
多能性幹細胞(iPS細胞・ES細胞)の特徴と臨床応用の現状
多能性幹細胞は、理論上あらゆる組織の細胞に分化できる能力を持っています。特に京都大学の山中伸弥教授が開発したiPS細胞(人工多能性幹細胞)は、倫理的な課題が少ないこともあり、日本発の技術として大きな注目を集めています。
ES細胞(胚性幹細胞)とともに、パーキンソン病や加齢黄斑変性、心不全などの治療に向けた臨床試験が進められています。現在は、自家移植から他家移植(備蓄細胞の利用)へとシフトすることで、コストダウンと普及を目指す動きが活発化しています。
体性幹細胞(間葉系幹細胞/MSC)の安全性と実用性
体性幹細胞の中でも、間葉系幹細胞(MSC)は現在最も実用化が進んでいる細胞ソースです。骨髄や脂肪などから比較的容易に採取でき、分化能力は限定的ですが、高い安全性と免疫調整能力を持っています。
MSCは、損傷部位に集積して修復を促すだけでなく、抗炎症作用や血管新生作用などのパラクライン効果(液性因子の分泌)も期待されています。培養技術が確立されており、脳梗塞や脊髄損傷、変形性関節症など、幅広い疾患での承認製品や自由診療での活用実績があります。
免疫細胞療法(CAR-T療法など)の概要とがん治療への応用
免疫細胞療法は、患者の免疫細胞を取り出し、活性化・増殖させて再び体内に戻すことで、がん細胞などを攻撃する治療法です。近年特に注目されているのが、遺伝子改変技術を用いた「CAR-T療法」です。
CAR-T療法は、T細胞にがん細胞を認識するアンテナ(CAR)を導入することで、高い治療効果を発揮します。血液がん領域で画期的な成果を上げており、固形がんへの応用も研究されていますが、高額な製造コストが課題として残されています。
主要な細胞ソース別比較:脂肪・骨髄・臍帯・歯髄・滑膜
同じ間葉系幹細胞(MSC)でも、採取する組織によって特性や採取の侵襲度が異なります。ビジネス展開を検討する際は、以下の特徴を把握しておくことが重要です。
| 細胞ソース | 採取の侵襲度 | 増殖能 | 特徴 |
|---|---|---|---|
| 脂肪 | 低い | 高い | 採取量が確保しやすく、美容・整形外科領域でも普及。 |
| 骨髄 | 中〜高い | 中程度 | 研究の歴史が長くエビデンスが豊富。採取に痛みを伴う。 |
| 臍帯 | なし | 非常に高い | 出産時に採取するためドナーへの負担がない。若く活性が高い。 |
| 歯髄 | 低い | 高い | 乳歯や親知らずから採取。神経系疾患への応用が期待される。 |
| 滑膜 | 中程度 | 高い | 軟骨への分化能が高く、関節治療に適している。 |
このように、ターゲットとする疾患や製品コンセプトに合わせて最適なソースを選定する必要があります。
自家移植と同種(他家)移植のビジネス的観点からの比較
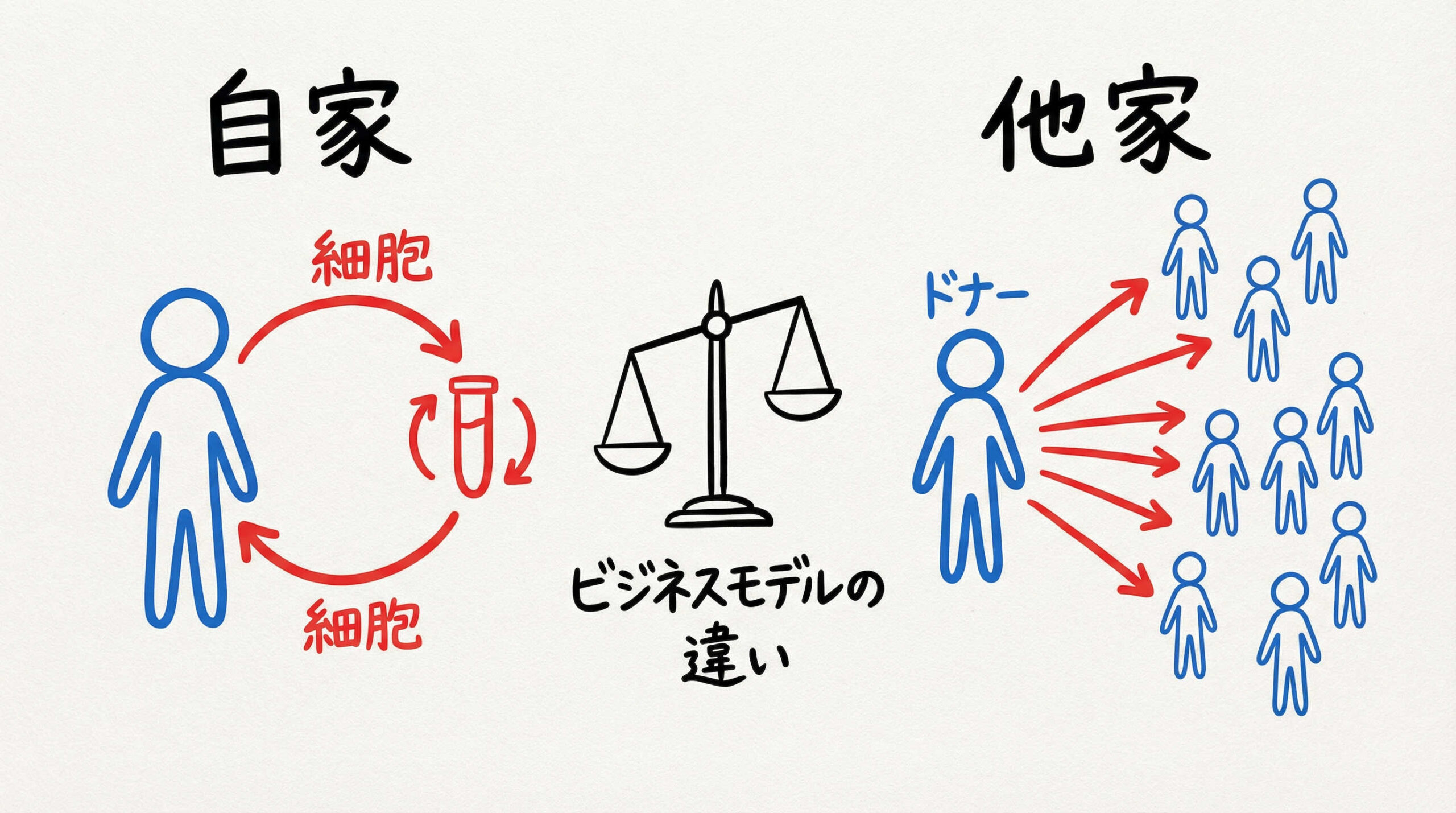
再生医療のビジネスモデルを考える上で、「誰の細胞を使うか」はコスト構造やサプライチェーンを決定づける最大の要因です。ここでは、自家移植(オート)と同種移植(アロ)の違いを、ビジネス的な観点から比較・解説します。
自家移植(オート):拒絶反応リスクの低さとオーダーメイド治療
自家移植は、患者自身の細胞を使用するため、拒絶反応のリスクが極めて低いことが最大のメリットです。安全性プロファイルが良好で、倫理的な懸念も少ないため、初期の再生医療製品の多くは自家移植でした。
しかし、ビジネス視点では「完全オーダーメイド」となるため、製造コストが高止まりしやすいという課題があります。患者ごとに製造ラインを確保し、厳格な品質管理を行う必要があるため、スケーラビリティ(規模の拡大)の確保が難しい側面があるでしょう。
同種移植(アロ):大量製造によるコストダウンと即時使用の可能性
同種移植(他家移植)は、健康なドナーから採取した細胞を大量に培養・加工し、多くの患者に投与するモデルです。医薬品のように在庫として保管できるため、必要な時にすぐに使用できる「即時性」が大きな強みです。
大量生産によるスケールメリットが働くため、製造コストを大幅に削減できる可能性があります。一方で、他人の細胞を入れることによる免疫拒絶反応のリスク管理や、ドナーのスクリーニングなど、安全性確保のための別のハードルが存在します。
ビジネスモデルの違いとサプライチェーン構築のポイント
自家と同種では、サプライチェーンの構造が根本的に異なります。自家移植の場合、医療機関と加工施設の間で細胞を往復させる「双方向」の物流が必要であり、個体識別管理(Chain of Identity)が極めて重要になります。
対して同種移植は、製造所から医療機関への「一方向」の物流となり、従来の医薬品流通に近い形になります。事業計画を策定する際は、どちらのモデルを採用するかによって、物流パートナーの選定やITシステムの要件が大きく変わることを念頭に置く必要があるでしょう。
【法規制】再生医療等安全性確保法(再生医療新法)の区分と要件
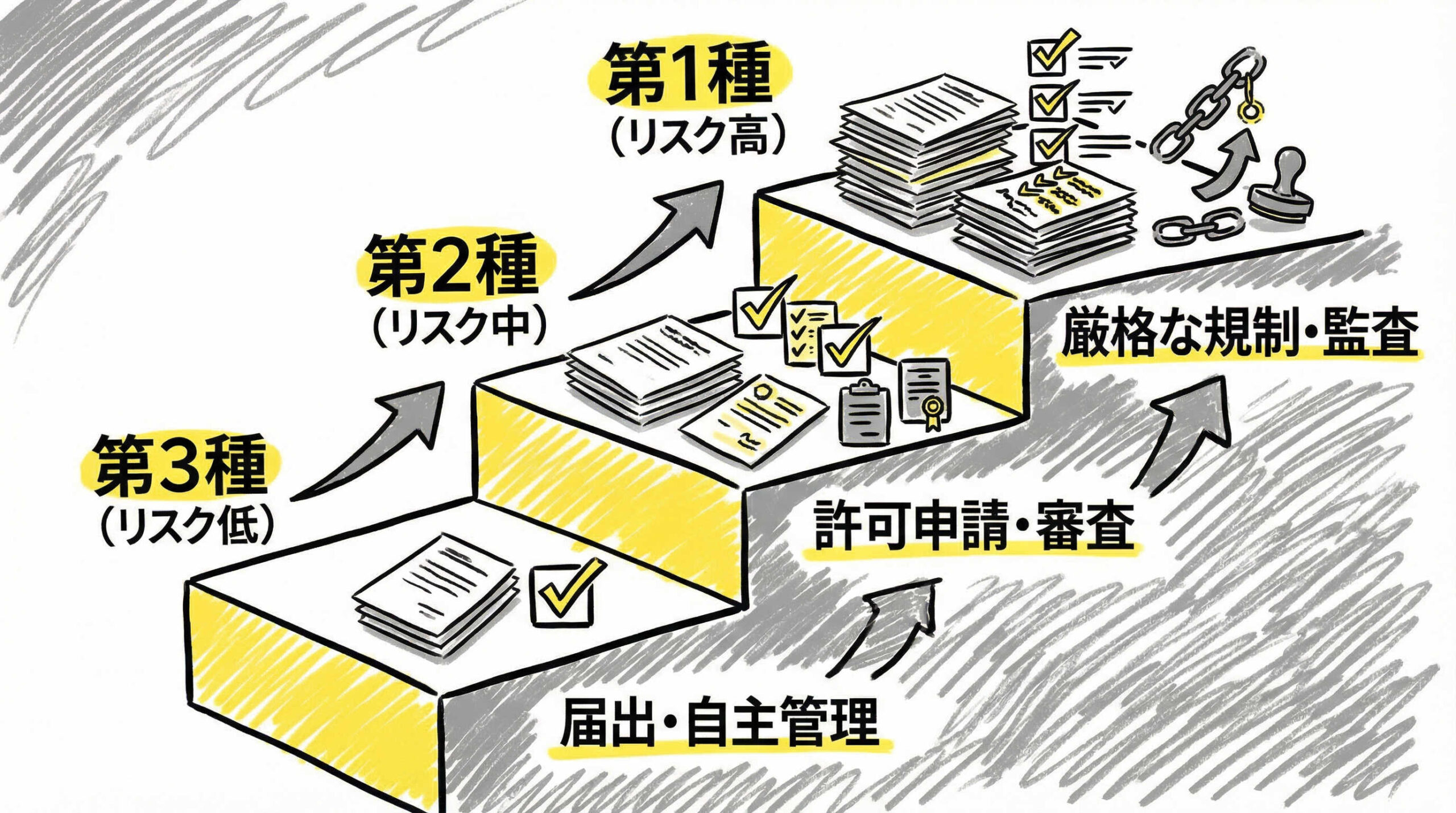
日本における再生医療は、「再生医療等安全性確保法」によってリスクに応じた3つの区分に分類され、規制されています。実務担当者として、自社の扱う技術がどの区分に該当し、どのような手続きが必要かを理解しておくことは必須です。
第一種再生医療等:ES/iPS細胞や他家幹細胞等の高リスク群
第一種再生医療等は、人の生命や健康に重大な影響を与える恐れがある、リスクが最も高い区分です。具体的には、ES細胞やiPS細胞を用いるもの、他人の幹細胞を利用するものなどが該当します。
この区分を実施するには、特定認定再生医療等委員会での審査を経た上で、厚生労働大臣への「提供計画」の提出と、さらに猶予期間を除き実施の許可が必要となるケースもあり、極めて厳格な手続きが求められます。
第二種再生医療等:自家体性幹細胞等の培養実績がある中リスク群
第二種再生医療等は、中程度のリスクがあると考えられる区分です。現在、多くのクリニックで行われている「自己脂肪由来間葉系幹細胞」を用いた治療などがこれに含まれます。
培養した細胞を用いるものの、自家移植であり、かつ過去に一定の使用実績があるものが対象となります。実施には、特定認定再生医療等委員会での審査と、厚生労働大臣への提供計画の提出が必要です。第一種と同様に特定委員会での審査が必要である点に注意しましょう。
第三種再生医療等:PRP療法や加工を施さない低リスク群
第三種再生医療等は、リスクが比較的低いと考えられる区分です。細胞の培養などの加工を行わないPRP療法(多血小板血漿療法)などが代表的です。
この区分では、認定再生医療等委員会(特定ではない)での審査と、厚生労働大臣への提供計画の提出が求められます。手続きのハードルは一種・二種に比べて低いものの、適切な衛生管理や体制整備は当然必要となります。
特定認定再生医療等委員会と認定再生医療等委員会の役割の違い
委員会の種類によって、審査できる再生医療等の区分が異なります。「特定認定再生医療等委員会」は、高度な専門知識を持つ委員で構成され、第一種・第二種という高・中リスクの審査を担当します。
一方、「認定再生医療等委員会」は、主に第三種の審査を行います。自社が提携する医療機関が治療を行う際、どの委員会に審査を依頼すべきかを間違えないよう、区分の判定は慎重に行う必要があります。
再生医療等提供計画の提出プロセスと留意点
再生医療等提供計画の提出は、以下のプロセスで進みます。
- 提供計画書の作成: 実施体制、細胞の加工方法、同意説明文書などを準備。
- 委員会による審査: 科学的妥当性や倫理的配慮について審査を受ける。
- 厚生労働大臣への提出: 委員会の「適合」意見書を添えて提出。
- 受理・実施開始: 計画が受理されて初めて治療提供が可能に。
留意点として、計画に変更が生じた場合も変更届や新たな審査が必要になることがあります。常に最新の規制情報を確認し、コンプライアンスを遵守した運用を心がけましょう。
再生医療業界における最新トレンドと技術革新
再生医療の分野は技術革新のスピードが非常に速く、次々と新しいコンセプトが登場しています。ここでは、細胞そのものを使わない治療法や、遺伝子治療との融合など、今まさに市場を賑わせている最新トレンドについて解説します。
細胞を用いない治療法「Cell-free therapy」へのパラダイムシフト
これまでの再生医療は「生きた細胞」を移植することが常識でしたが、近年では細胞そのものを投与しない「Cell-free therapy(セルフリー療法)」へのパラダイムシフトが起きています。
細胞が分泌する培養上清液などを利用することで、細胞移植と同等の効果を狙うものです。生きた細胞を扱わないため、がん化のリスクや輸送時の品質劣化リスクを低減でき、ハンドリングが容易になるという大きなメリットがあります。
エクソソーム(細胞外小胞)の治療応用と美容・抗老化分野での拡大
Cell-free therapyの中でも特に注目されているのが「エクソソーム(細胞外小胞)」です。エクソソームは細胞間の情報伝達を担うカプセルで、中にはmiRNAなどのメッセージ物質が含まれています。
抗炎症作用や組織修復作用を持つことから、医療用途だけでなく、美容クリニックにおける肌質改善や抗老化(アンチエイジング)メニューとしても急速に普及しています。ただし、規格化や品質管理の基準作りが急務となっている分野でもあります。
遺伝子治療と再生医療の融合(ex vivo遺伝子治療)
再生医療と遺伝子治療の境界線が曖昧になり、両者が融合した「ex vivo遺伝子治療」が進化しています。これは、患者から採取した細胞に体外で遺伝子操作を加え、機能を修正してから体内に戻す手法です。
前述のCAR-T療法もこれに該当しますが、さらに鎌状赤血球症などの遺伝性疾患に対する治療法としても実用化が進んでいます。細胞技術と遺伝子工学の掛け合わせにより、これまで治療不可能だった疾患へのアプローチが可能になっています。
ゲノム編集技術を用いたデザイナー細胞(機能強化型細胞)の開発
ゲノム編集技術(CRISPR-Cas9など)を用いて、細胞の機能を人為的に強化した「デザイナー細胞」の開発も進んでいます。例えば、免疫拒絶反応を起こしにくくしたiPS細胞や、特定のがん環境下でのみ活性化する免疫細胞などです。
自然界に存在する細胞の能力を超える機能を持たせることで、治療効果を最大化し、副作用を最小化することを目指しています。次世代の再生医療製品の主役となる可能性を秘めた技術トレンドです。
自動培養技術とAI活用による製造コスト削減・品質安定化
産業化における最大の課題である「製造コスト」と「品質のばらつき」を解決するため、自動培養装置やAI(人工知能)の導入が進んでいます。熟練技術者の手技をロボットで再現したり、細胞の画像をAIが解析して培養状態を最適化したりする試みです。
人手に頼らない製造プロセス(マニュファクチャリング)を確立することは、製品の安定供給と低価格化を実現し、再生医療を一般的な医療として普及させるために不可欠な要素となっています。
再生医療の社会実装に向けた課題と今後の展望
大きな可能性を秘めた再生医療ですが、社会全体に広く普及(社会実装)させるためには、いくつかの高いハードルを越える必要があります。ここでは、現在業界が直面している課題と、それを乗り越えた先の展望について考察します。
GCTP省令に基づく厳格な品質管理と製造コストの壁
再生医療等製品の製造には、GCTP(Good Gene, Cellular, and Tissue-based Products Manufacturing Practice)省令に基づく厳格な品質管理が求められます。無菌操作が必須であり、特殊な設備や高度な管理体制が必要となるため、どうしても製造コストが膨らみがちです。
この「コストの壁」が薬価の高騰を招き、普及の妨げとなることがあります。今後は、プロセスの自動化や閉鎖系製造システムの導入による効率化、そして規制当局との対話を通じた合理的かつ安全な品質基準の策定が求められます。
自由診療市場の適正化とエビデンス構築の重要性
現在、日本国内では自由診療として多くの再生医療が提供されていますが、中には科学的根拠(エビデンス)が乏しい治療が含まれているという指摘もあります。
業界全体の信頼性を維持・向上させるためには、自由診療であってもデータを蓄積し、エビデンスを構築していく姿勢が重要です。リアルワールドデータの活用や、学会主導のレジストリ登録などを通じて、透明性の高い治療実績を示していくことが、患者からの信頼獲得につながるでしょう。
条件及び期限付承認制度を活用した早期実用化戦略
日本には、再生医療等製品を早期に患者へ届けるための「条件及び期限付承認制度」があります。これは、有効性が推定できれば、安全性を確認した上で特別に早期承認を与える世界に先駆けた制度です。
この制度を戦略的に活用することで、開発期間の短縮と早期の収益化が可能になります。ただし、市販後に有効性を確定するためのデータを収集することが義務付けられており、承認取得後の調査計画も含めた長期的な事業戦略が不可欠です。
まとめ

再生医療は、研究段階から産業化フェーズへと移行し、多能性幹細胞やMSC、さらにはエクソソームや遺伝子治療との融合など、技術トレンドも日々進化しています。ビジネスにおいては、自家・他家のモデル選択や、法規制(一種〜三種)の正確な理解、そしてGCTP対応などの品質管理が成功の鍵を握ります。
課題は残るものの、条件付き承認制度の活用や自動化技術の進展により、市場は今後も拡大を続けるでしょう。常に最新情報をアップデートし、適切な戦略を構築することが、この革新的な分野での事業成長につながります。
再生医療の基礎知識と最新トレンドについてよくある質問

再生医療の導入やビジネス展開において、よく寄せられる質問をまとめました。実務の参考にしてください。
- Q. 再生医療と従来の医療の決定的な違いは何ですか?
- A. 従来の医療が症状を抑える「対症療法」中心であるのに対し、再生医療は細胞の力を利用して失われた機能を回復させる「根本治療」を目指す点が決定的に異なります。
- Q. 自家移植と他家移植、ビジネスとして参入しやすいのはどちらですか?
- A. 一概には言えませんが、初期投資を抑え小規模に始めるならクリニック等での「自家移植」が、医薬品として大規模展開を狙うなら「他家移植」がモデルとして一般的です。
- Q. 再生医療新法の第一種と第二種の違いを簡単に教えてください。
- A. 主にリスクの高さで区分されます。iPS/ES細胞や他人の細胞を使う場合は「第一種(高リスク)」、自分の体性幹細胞を使う場合は「第二種(中リスク)」となります。
- Q. エクソソーム治療は再生医療新法の対象になりますか?
- A. 現時点では、細胞を含まないエクソソーム単体は再生医療新法の対象外(医薬品医療機器等法の対象となる可能性あり)とされていますが、規制動向は流動的であり注意が必要です。
- Q. 再生医療の治療費が非常に高額なのはなぜですか?
- A. 安全性を確保するための厳格な無菌管理、高度な培養技術、人件費、そして品質試験に多大なコストがかかるためです。自動化によるコストダウンが期待されています。
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "再生医療と従来の医療の決定的な違いは何ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "従来の医療が症状を抑える「対症療法」中心であるのに対し、再生医療は細胞の力を利用して失われた機能を回復させる「根本治療」を目指す点が決定的に異なります。"
}
},
{
"@type": "Question",
"name": "自家移植と他家移植、ビジネスとして参入しやすいのはどちらですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "一概には言えませんが、初期投資を抑え小規模に始めるならクリニック等での「自家移植」が、医薬品として大規模展開を狙うなら「他家移植」がモデルとして一般的です。"
}
},
{
"@type": "Question",
"name": "再生医療新法の第一種と第二種の違いを簡単に教えてください?",
"acceptedAnswer": {
"@type": "Answer",
"text": "主にリスクの高さで区分されます。iPS/ES細胞や他人の細胞を使う場合は「第一種(高リスク)」、自分の体性幹細胞を使う場合は「第二種(中リスク)」となります。"
}
},
{
"@type": "Question",
"name": "エクソソーム治療は再生医療新法の対象になりますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "現時点では、細胞を含まないエクソソーム単体は再生医療新法の対象外(医薬品医療機器等法の対象となる可能性あり)とされていますが、規制動向は流動的であり注意が必要です。"
}
},
{
"@type": "Question",
"name": "再生医療の治療費が非常に高額なのはなぜですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "安全性を確保するための厳格な無菌管理、高度な培養技術、人件費、そして品質試験に多大なコストがかかるためです。自動化によるコストダウンが期待されています。"
}
}
]
}