再生医療や遺伝子治療の分野は日進月歩で進化しており、新たな治療法としての期待が高まっています。しかし、その実用化に向けたハードル、特に「再生医療等製品の承認プロセス」は、従来の医薬品とは異なる複雑なスキームが存在するため、開発担当者様にとっては大きな課題となることも多いでしょう。
薬機法に基づく独自の「条件付き・期限付き承認制度」や、GCTP省令への対応など、再生医療特有の規制を正しく理解することは、手戻りのない開発戦略を立てる上で不可欠です。
本記事では、PMDA(医薬品医療機器総合機構)との相談から承認申請、そして市販後の調査に至るまでの具体的なフローを、実務的な視点で解説します。承認取得までの道のりを体系的に把握し、プロジェクトを成功へ導くための一助としていただければ幸いです。
再生医療等製品における承認プロセスの全体像と結論
再生医療等製品の開発は、従来の医薬品とは異なる独自の法規制と承認スキームの下で行われます。特に日本においては、革新的な医療技術をいち早く患者さんに届けるため、世界に先駆けた柔軟な制度設計がなされています。まずは、その全体像と、開発戦略の核となる「条件付き・期限付き承認制度」について理解を深めましょう。
通常の医薬品承認プロセスとの決定的な違い
再生医療等製品と低分子医薬品などの通常の医薬品とでは、その性質に決定的な違いがあります。再生医療等製品は、生きた細胞や組織を扱うため、品質の不均一性が避けられず、有効性の予測も困難な場合が少なくありません。
そのため、承認プロセスにおいても以下のような違いが生じます。
- 品質管理の考え方: 最終製品の規格試験だけでなく、製造プロセス全体での管理(GCTP)がより重視される。
- 臨床データの扱い: 大規模な検証的治験(第III相試験)の実施が困難な場合があり、少数の症例データでの評価が求められることがある。
このように、製品の特性に合わせた柔軟かつ科学的な審査が行われるのが特徴です。
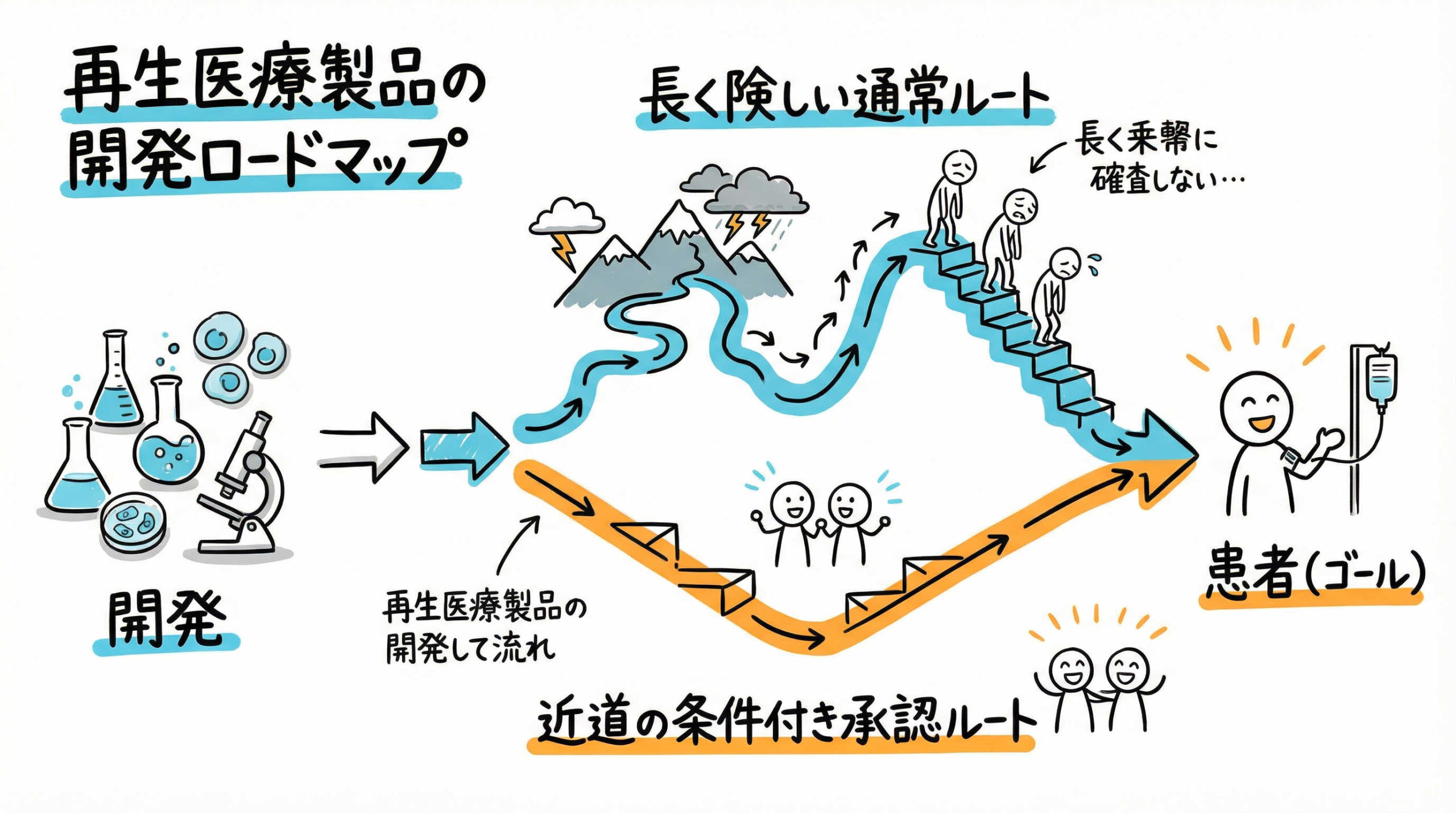
早期実用化を叶える「条件付き・期限付き承認制度」の仕組み
再生医療等製品の開発において最も特筆すべき制度が、2014年の薬機法改正で導入された「条件付き・期限付き承認制度」です。これは、臨床試験において「有効性が推定」され、「安全性が確認」されれば、特別に承認を与えるという仕組みです。
制度の主な特徴:
- 早期承認: 検証的治験(第III相)を待たずに、第I/II相試験の結果等で承認される可能性がある。
- 期限付き: 承認には期限(最大7年)が設けられ、その間に市販後データを収集し、改めて本承認申請を行う必要がある。
- 条件付き: 使用できる施設や医師の要件など、厳格な条件が付される。
この制度により、開発期間の大幅な短縮と、早期の収益化が可能となります。
開発着手から承認取得・市販後までの標準的なタイムライン
開発プロジェクトを立ち上げてから承認を取得し、市販後に至るまでの標準的な流れは以下のようになります。
- 基礎研究・非臨床試験: 薬理作用や安全性の確認。
- PMDA相談(RS戦略相談): 開発方針のすり合わせ。
- 臨床試験(治験):
- 探索的治験(少人数での安全性・有効性確認)
- 検証的治験(条件付き承認を目指す場合は省略または縮小されることも)
- 承認申請: PMDAによる審査。
- 承認取得(条件付き・期限付き含む): 販売開始。
- 市販後調査・使用成績調査: 全例調査などが義務付けられることが多い。
- 再審査申請: 本承認への切り替え(条件付きの場合)。
各フェーズで規制当局との綿密な対話が必要不可欠です。
承認プロセスの前提となる法規制と製品区分
承認プロセスを正確に理解するためには、その前提となる「法的な定義」や「製品区分」をクリアにしておく必要があります。自社の製品がどのカテゴリーに属するかによって、適用される規制や必要なデータセットが大きく異なるからです。ここでは、薬機法上の定義とリスク区分について解説します。
医薬品医療機器等法(薬機法)における再生医療等製品の定義
「再生医療等製品」とは、医薬品医療機器等法(薬機法)第2条第9項において定義されています。具体的には、以下のいずれかに該当するものを指します。
- ヒト細胞加工製品: 人または動物の細胞に培養等の加工を施したもので、身体の構造・機能の再建、修復、形成、または疾病の治療・予防に使用されるもの。
- 遺伝子治療用製品: 人または動物の細胞に導入して使用される遺伝子、または遺伝子を含む細胞であって、疾病の治療に使用されるもの。
単なる細胞の洗浄や保存のみでは該当せず、「加工」の程度が判断基準となります。
ヒト細胞加工製品・遺伝子治療用製品の分類とリスク区分
製品のリスクに応じた適切な管理を行うため、再生医療等製品はその由来や性質によって分類されます。特に細胞加工製品については、リスクの程度により審査の厳格さが変わる場合があります。
- 自家(Autologous): 患者自身の細胞を使用。免疫拒絶のリスクは低いが、製造の個別性が高い。
- 他家(Allogeneic): 他人の細胞を使用。大量生産が可能だが、免疫反応や感染症伝播のリスク管理がより重要。
また、遺伝子治療用製品においては、ベクターの種類(ウイルスベクターか非ウイルスベクターか)や、生体内での挙動(複製能の有無など)によってもリスク評価が異なります。これらの特性を早期に把握し、リスクに応じた開発計画を策定しましょう。
第一種・第二種・第三種再生医療等の提供計画との関係性
ここで混同しやすいのが、「再生医療等の安全性の確保等に関する法律(再生医療新法)」に基づく提供計画との関係です。
- 薬機法(再生医療等製品): 企業が製造販売承認を取得し、製品として広く販売するもの。保険収載を目指すのが一般的。
- 再生医療新法(提供計画): 医療機関が自由診療や臨床研究として実施するもの。第一種(高リスク)、第二種(中リスク)、第三種(低リスク)に分類され、特定認定再生医療等委員会での審査が必要。
企業主導の治験(薬機法承認目的)を行う場合でも、医療機関側では提供計画の手続きが必要になるケースがあるため、両法の関係性を整理しておくことが重要です。
【実務解説】PMDA相談から承認申請までの具体的フロー
ここからは、実際に開発担当者が直面する実務的なフローについて詳しく解説します。PMDAとの対面助言から始まり、膨大な資料作成を経て承認申請に至るまでのプロセスは、非常に緻密な作業の連続です。各ステップでのポイントを押さえましょう。
開発初期段階におけるRS戦略相談(レギュラトリーサイエンス戦略相談)の活用
再生医療等製品の開発において、PMDAが実施する「レギュラトリーサイエンス(RS)戦略相談」の活用は、成功の鍵を握ると言っても過言ではありません。
この相談では、開発の早期段階から以下の点について指導を受けることができます。
- 製品の品質・安全性に関する試験計画の妥当性
- 治験プロトコルの骨子
- 承認申請に必要なデータパッケージの範囲
特に、前例の少ない新規技術の場合、PMDA側の考え方を早期に確認し、開発の方向修正を行うことで、無駄な試験や手戻りを防ぐことができます。対面助言の議事録は、後の審査においても重要な根拠資料となります。
カルタヘナ法への対応(遺伝子組換え生物等の使用等の規制)
遺伝子治療用製品や、遺伝子導入細胞を使用する場合、「カルタヘナ法(遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律)」への対応が必須となります。
これは、環境中への遺伝子組換え生物の拡散防止を目的とした法律です。治験を開始する前に、第一種使用規程の承認申請を行い、環境大臣(および厚生労働大臣)の承認を得る必要があります。このプロセスには数ヶ月を要するため、全体のタイムラインに組み込んでおくことが重要です。承認が得られない限り、治験薬の搬入や投与を開始することはできません。
非臨床安全性試験の実施とデータの信頼性確保
ヒトに投与する前の非臨床試験では、製品の安全性と効力を科学的に証明する必要があります。再生医療等製品特有の評価項目として、以下のような点が挙げられます。
- 造腫瘍性試験: 投与した細胞ががん化しないかどうかの確認。
- 生体内分布: 投与された細胞や遺伝子が体内のどこに移動し、どれ期間残留するか。
- 免疫原性: 異種・他家細胞に対する免疫反応の評価。
これらの試験は、GLP(Good Laboratory Practice)基準に準拠して実施され、データの信頼性が担保されている必要があります。試験デザインの段階でPMDAと合意形成しておくことが望ましいでしょう。
治験届の提出と臨床試験(治験)の実施プロセス
非臨床試験で安全性が確認された後、いよいよ治験届を提出し、臨床試験(治験)を開始します。再生医療等製品の治験は、対象患者数が限られることが多いため、試験デザインの工夫が求められます。
- 探索的治験: 少数例で安全性と予備的な有効性を確認。
- 検証的治験: 有効性を検証する試験。ただし、条件付き承認を目指す場合は、探索的治験の結果をもって申請を行うケースもあります。
治験実施中は、GCP(Good Clinical Practice)を遵守し、有害事象のモニタリングやデータの品質管理を徹底する必要があります。
承認申請書の作成とCTD(コモン・テクニカル・ドキュメント)の準備
治験が終了し、良好な結果が得られたら、承認申請書の作成に移ります。申請資料は、国際的な標準フォーマットであるCTD(コモン・テクニカル・ドキュメント)に基づいて構成されます。
再生医療等製品では、特に「モジュール3(品質に関する文書)」の作成が難所となりがちです。原材料の管理、製造工程の妥当性、製品の規格設定などについて、論理的かつ詳細に記述する必要があります。また、条件付き承認を希望する場合は、その妥当性を説明する資料も重要になります。膨大な資料となるため、計画的な作成とレビュー体制が必要です。
チーム審査・面接審査および専門協議への対応
申請書提出後は、PMDAの審査チームによる審査が始まります。書面審査だけでなく、面接審査や専門協議が行われます。
- 照会事項への回答: 審査官からの質問(照会事項)に対し、限られた期間内で的確に回答する必要があります。
- 専門協議: 外部の専門家を交えた議論の場です。ここでは、臨床的な意義やリスク・ベネフィットのバランスについて高度な議論が交わされます。
これらの対応いかんで、承認の可否や承認条件(適応範囲など)が左右されるため、迅速かつ誠実な対応が求められます。
審査通過の鍵となる査察・調査対応
承認審査は、提出された書類の審査だけでは完結しません。実際に試験データが正しく取得されたか、製造所で適切な管理が行われているかを確認する「実地調査」が非常に重要なウェイトを占めます。ここでは、査察・調査対応の勘所を解説します。
適合性書面調査(GCP実地調査)のポイント
適合性書面調査(およびGCP実地調査)は、申請資料の元となった治験データが、GCPを遵守して信頼性高く収集されたものかを確認する調査です。
調査官は、医療機関(治験実施施設)や依頼者(製薬企業)を訪問し、原資料(カルテや検査データ)と申請資料との突合を行います。ここでデータの整合性が取れない、あるいはプロセス上の重大な違反が見つかった場合、データ自体が無効となり、承認が得られない可能性があります。日頃からのモニタリングや監査による品質管理が問われる場面です。
GCTP省令に基づいた製造管理・品質管理体制の構築
再生医療等製品の製造所は、GCTP(Good Gene, Cellular, and Tissue-based Products Manufacturing Practice)省令に基づいた管理体制を構築しなければなりません。医薬品のGMPとは異なり、無菌操作や交叉汚染防止について、より厳格かつ特殊な管理が求められます。
特に、ドナーの受け入れから製品の出荷に至るまでのトレーサビリティの確保や、無菌性が担保された製造環境(アイソレーターや安全キャビネットの使用等)の維持管理が重要です。製造管理者や品質保証責任者の配置など、人的要件も満たす必要があります。
GCTP実地調査における主な指摘事項と対策
承認前に行われるGCTP実地調査では、製造所における実際の運用状況がチェックされます。よくある指摘事項として以下のようなものがあります。
- 記録の不備: 製造記録や試験記録の記載ミス、訂正方法の誤り。
- 逸脱管理の不十分さ: 手順書からの逸脱があった際の対応や原因究明、再発防止策が不十分。
- バリデーションの不足: 無菌性保証や洗浄バリデーションのデータ不足。
これらの指摘は、承認の遅延に直結します。模擬査察(Mock Inspection)を実施するなどして、事前に不備を洗い出し、万全の準備を整えておくことが大切です。
承認取得後の市販後調査と本承認への道のり
晴れて承認を取得しても、それで終わりではありません。特に「条件付き・期限付き承認」の場合、市販後は「仮免許」の状態とも言えます。本承認(正規の承認)を勝ち取るためには、市販後の活動が極めて重要になります。
使用成績調査および全例調査の実施要件
再生医療等製品は、治験での症例数が少ないまま承認されることが多いため、市販後に全症例を対象とした調査(全例調査)が承認条件として課されることが一般的です。
この調査では、実臨床下での安全性情報や有効性データを網羅的に収集します。企業は、登録センターを設置し、使用するすべての医療機関からデータを収集・解析する体制を整える必要があります。医師や医療機関の負担も大きくなるため、円滑な実施に向けたサポート体制の構築も重要なお仕事となります。
条件付き承認における期限内の有効性・安全性データの蓄積
条件付き承認の場合、指定された期限(例:7年)内に、承認条件として課された有効性・安全性のデータを蓄積し、再審査申請を行わなければなりません。
もし期限内に十分なデータが集まらなかったり、有効性が確認できなかったりした場合、承認が取り消されるリスクもあります。そのため、市販後の症例登録の進捗管理は、開発段階と同じくらい、あるいはそれ以上にシビアに行う必要があります。リアルワールドデータの活用など、効率的なデータ収集戦略が求められます。
再審査申請と本承認取得へのプロセス
期限が到来する前に、蓄積されたデータをまとめて「再審査申請」を行います。これは実質的に、本承認を得るための審査プロセスです。
ここで改めて、有効性と安全性が再評価され、問題なしと判断されれば、条件や期限が解除された通常の承認(本承認)へと移行します。この段階を経て初めて、製品としての地位が盤石なものとなります。長い道のりですが、患者さんへ安定的に製品を届けるための最後の関門と言えるでしょう。
開発期間短縮のための優先審査スキーム

画期的な治療法を一日も早く患者さんに届けるため、国はいくつかの優先審査スキームを用意しています。これらを上手く活用することで、開発期間の短縮や審査の優先的な取り扱いを受けることが可能になります。
先駆け審査指定制度の要件とメリット
「先駆け審査指定制度」は、世界に先駆けて日本で開発され、画期的な有効性が期待される製品を対象とした制度です。指定を受けると、以下のようなメリットがあります。
- 優先相談: PMDA相談の待ち時間が短縮される。
- 事前評価: 申請前からデータを順次提出し、事前評価を受けられる。
- 優先審査: 承認審査の目標期間が通常より短縮される(例:6ヶ月程度を目指す)。
指定要件は厳しいですが、開発スピードを劇的に早める強力なツールとなります。
希少疾病用再生医療等製品(オーファン)指定制度の活用
対象患者数が少ない(5万人未満など)難病などの治療薬については、「希少疾病用再生医療等製品(オーファン製品)」の指定を受けられる可能性があります。
指定を受けると、助成金の交付や、税制上の優遇措置に加え、優先審査の対象となります。また、再審査期間(独占販売期間のようなもの)が延長されるメリットもあります。ニッチな疾患をターゲットとすることが多い再生医療等製品において、この制度の活用は経済的な合理性を確保する上でも非常に有効です。
まとめ

再生医療等製品の承認プロセスは、通常の医薬品とは異なる「条件付き・期限付き承認制度」や「GCTP基準」など、独自の法規制への深い理解が必要です。PMDAとの早期からの戦略相談、カルタヘナ法への対応、そして市販後の全例調査まで、各フェーズでの緻密な計画と実行力が求められます。
道のりは平坦ではありませんが、これらのプロセスを一つひとつクリアしていくことが、革新的な治療を待ち望む患者さんの希望へと繋がります。本記事で解説したフローやポイントを、貴社の開発戦略にお役立てください。
再生医療等製品の承認プロセス解説についてよくある質問

以下に、再生医療等製品の承認プロセスに関して、よく寄せられる質問とその回答をまとめました。
- 条件付き・期限付き承認はすべての製品に適用されますか?
- いいえ、適用されません。生命を脅かす疾患や、有効な治療法がない疾患など、医療上の必要性が高く、かつ検証的治験の実施が困難な場合に、その適用が検討されます。
- GCTPとGMPの主な違いは何ですか?
- GCTPは再生医療等製品特有の基準であり、特に原材料(細胞等)の受け入れ時の検査や、無菌操作、製品のトレーサビリティ(追跡可能性)の確保がGMPよりも厳格に求められます。
- カルタヘナ法の承認にはどのくらいの期間がかかりますか?
- 第一種使用規程の承認申請から承認までは、概ね4〜6ヶ月程度かかることが一般的です。治験開始時期に影響するため、早めの準備が必要です。
- 再生医療等製品の審査期間は通常どのくらいですか?
- 標準的な審査期間は申請から約12ヶ月とされていますが、先駆け審査指定品目や希少疾病用製品の場合は、優先審査により9ヶ月程度(またはそれ以下)に短縮されることを目指します。
- ベンチャー企業がPMDA相談を利用する際の注意点は?
- 相談資料の質が回答の質を左右します。単に「どうすればいいか」を聞くのではなく、自社の考えや科学的根拠に基づいた提案を用意し、「この方針で良いか」を確認するスタンスで臨むことが重要です。